
La sindrome di Lambert Eaton
Cos’è la sindrome miasteniforme di Lambert Eaton?
La sindrome di Lambert Eaton (Lambert-Eaton Myasthenic Syndrome, LEMS) è una malattia autoimmune della giunzione neuromuscolare ovvero del punto in cui le cellule nervose entrano in contatto con le cellule muscolari.
E’una patologia rara, con una prevalenza di 2.3 and 3.8 per un milione di individui, che colpisce prevalentemente persone adulte, con due picchi di età di esordio: uno nei giovani adulti (35 anni) e uno nell’età medio-avanzata (60 anni).
Come si manifesta
I sintomi principali sono debolezza muscolare, affaticamento e crampi, che interessano principalmente gli arti inferiori e progrediscono lentamente nel tempo, anche se raramente i disturbi possono comparire più rapidamente, nell’arco di giorni o settimane. La debolezza inizia generalmente nella parte prossimale degli arti inferiori, ovvero nei muscoli delle anche e delle cosce, con difficoltà ad alzarsi da una sedia, a salire le scale e a camminare. La debolezza diffonde poi alle spalle e successivamente coinvolge le gambe e le braccia. La forza muscolare può migliorare temporaneamente dopo esercizio muscolare, per poi ridursi nuovamente. I muscoli del viso possono essere coinvolti, con comparsa di abbassamento delle palpebre e visione doppia, mentre più raramente compaiono abbassamento della voce e difficoltà nella deglutizione. Altri sintomi frequenti sono dovuti al coinvolgimento del sistema nervoso autonomico e comprendono secchezza delle fauci, impotenza, stitichezza e ipotensione ortostatica. Raramente, si associano sintomi dovuti al coinvolgimento cerebellare, come ad esempio il disequilibrio.
Cosa la causa
La LEMS è causata da anticorpi diretti contro un particolare canale voltaggio-dipendente del calcio (VGCC) che si trova a livello della giunzione neuromuscolare. La giunzione neuromuscolare trasforma l’impulso elettrico del nervo motore in contrazione muscolare.
L’arrivo di un potenziale d’azione nella porzione terminale del nervo motore determina l’apertura simultanea dei canali VGCC e la liberazione di un’elevata quantità di vescicole contenenti il neurotrasmettitore acetilcolina (ACh). Questo a sua volta si lega a specifici canali ionici (recettori dell’ACh = AChR) situati sulla membrana muscolare, determinando l’apertura dei canali stessi e l’ingresso di ioni sodio nella fibra muscolare. L’apertura sincrona di un gran numero di AChR con un massiccio ingresso di cariche positive causa una variazione del potenziale di membrana (depolarizzazione) della fibra muscolare (potenziale di placca); quando questo raggiunge un determinato valore di soglia, si verifica l’apertura dei canali voltaggio-dipendenti del sodio e si genera un potenziale d’azione che si propaga lungo la fibra e attiva la contrazione muscolare. L’ACh diffonde nello spazio sinaptico e viene inattivata dall’enzima acetilcolinesterasi (AChE).
Quando gli anticorpi si legano al canale VGCC ne alterano la funzione causando un blocco dell’afflusso di calcio e una conseguente riduzione del rilascio di Ach e quindi del potenziale di azione generato (Figura 1). La stimolazione nervosa ripetitiva ad alta frequenza, tuttavia, può aumentare l’ampiezza del potenzale di placca attraverso l’accumulo di calcio nel terminale presinaptico e un aumento del rilascio di ACh.
In più della metà dei casi, la sindrome è associata alla presenza o alla comparsa nei tre anni successivi alla diagnosi, di un tumore polmonare a piccole cellule (SCLC) o, raramente, di altri tipi di tumore. In questi casi si parla di LEMS paraneoplastica. Questa forma è più frequente in soggetti maschi, con un’età media di circa 60 anni. Più raramente, la formazione degli anticorpi avviene in assenza di un tumore, in pazienti con una predisposizione genetica a sviluppare malattie
autoimmuni. In questi casi si parla di LEMS non paraneoplastica. Tale forma, è più frequente in donne con un’età media di 35 anni.
Come si diagnostica
La diagnosi è basata sulla presentazione clinica, la dimostrazione di un disturbo della trasmissione neuromuscolare mediante l’elettromiografia (EMG) ed il riscontro degli anticorpi contro il canale VGCC. La malattia viene spesso diagnosticata con un ritardo medio di circa 4 mesi dall’esordio nei pazienti con forme paraneoplastiche e di 12 mesi nei pazienti con forme idiopatiche.
L’esame neurofisiologico di scelta per la diagnosi è la stimolazione nervosa ripetitiva (SNR). Questa indagine consiste nella stimolazione ripetitiva a bassa frequenza di un nervo motore, registrando il potenziale d’azione muscolare composto (CMAP) del muscolo corrispondente. La SNR a bassa frequenza equivale una contrazione muscolare sostenuta che, in condizioni fisiologiche, si accompagna ad una riduzione del rilascio di vescicole di ACh. Nei pazienti con sindrome miasteniforme, la trasmissione neuromuscolare subisce un blocco in un numero progressivamente maggiore di fibre muscolari e, di conseguenza il CMAP si riduce progressivamente a causa di un deficit di AChR. Una riduzione superiore al 10% del CMAP iniziale è considerata positiva. Questa risposta non è specifica della LEMS ma si osserva anche nei pazienti con miastenia. Tuttavia, a differenza della miastenia, nella LEMS, a causa della facilitazione, un breve esercizio fisico o una stimolazione nervosa ad alta frequenza provocano un aumento significativo dell’ampiezza dei CMAP (Figura 2). Un incremento del 70% è considerato diagnostico.
Gli anticorpi contro il VGCC, in particolare contro il sottotipo P/Q, vengono misurati nel sangue del paziente mediante radioimmunoprecipitazione e sono riscontrati in più dell’85% dei pazienti. Il test è considerato sensibile e specifico per la diagnosi di LEMS. Tuttavia, bassi livelli di questi anticorpi sono stati riscontrati anche in pazienti con altre patologie neurologiche, come ad esempio la malattia del motoneurone, così come in pazienti con tumore a piccole cellule del polmone senza sintomi neurologici. Pertanto, è fondamentale integrare i dati clinici, elettrofisiologici e anticorpali, al fine di raggiungere la diagnosi corretta. Non vi è correlazione tra i livelli anticorpali e i sintomi clinici o la prognosi e pertanto il monitoraggio nel tempo non è in genere indicato.
Tutti i pazienti con una nuova diagnosi di LEMS senza un tumore noto devono essere sottoposti ad una TC del torace e dell’addome, seguiti, in caso di negatività, da una 18FDG-PET. Se lo screening è negativo, deve essere ripetuto ogni 3 o 6 mesi almeno per 2 anni sulla base del profilo di rischio individuale.
Come si tratta
Il trattamento della LEMS include: a) farmaci sintomatici; b) immunoterapia; c) terapia oncologica in caso di tumore. Nelle forme paraneoplastiche, infatti, il trattamento oncologico determina spesso un miglioramento dei sintomi. Il trattamento sintomatico di scelta è la 3,4-diaminopiridina o amifampridina, che agisce bloccando i canali del potassio, prolungando la depolarizzazione della membrana presinaptica e aumentando il rilascio di Ach. Nei pazienti con sintomi residui o refrattari, è indicata l’immunoterapia. Il trattamento di prima linea sono le immunoglubiline endovena. Altri trattamenti includono i corticosteroidi orali, associati o meno ad azatioprina, e la plasmaferesi. Il rituximab è stato utilizzato con successo in casi refrattari ad altri trattamenti. Gli individui affetti da LEMS senza carcinoma polmonare presentano una sopravvivenza normale e un decorso stabile della malattia e rimangono indipendenti nella cura personale.
La prognosi è peggiore nei pazienti con carcinoma polmonare, ma questa dipende dallo stadio del tumore. Tuttavia, la sopravvivenza è più lunga nelle persone affette da LEMS con carcinoma polmonare a piccole cellule rispetto a coloro che presentano SCLC senza LEMS.
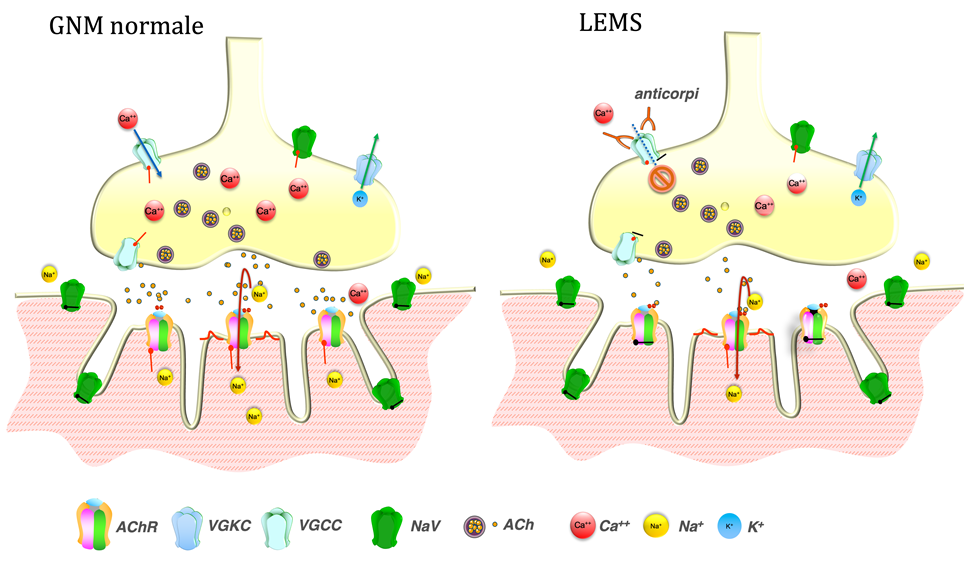
Figura 1. In condizioni normali, la depolarizzazione del terminale nervoso presinaptico determina l’afflusso di ioni calcio, il rilascio di acetilcolina (ACh) e il legame ai recettori ACh (AChR) con conseguente afflusso di ioni caricati positivamente, principalmente sodio, generazione di un potenziale di placca (EPP) e contrazione muscolare. L’apertura dei canali voltaggio-dipendenti del potassio (VGKC) sulla membrana presinaptica ripristina il potenziale di membrana e limita l’apertura dei VGCC. Nella LEMS, gli anticorpi VGCC bloccano l’afflusso di calcio provocando una riduzione dell’ACh rilasciato al terminale presinaptico con conseguente riduzione dell’ampiezza dell’EPP.
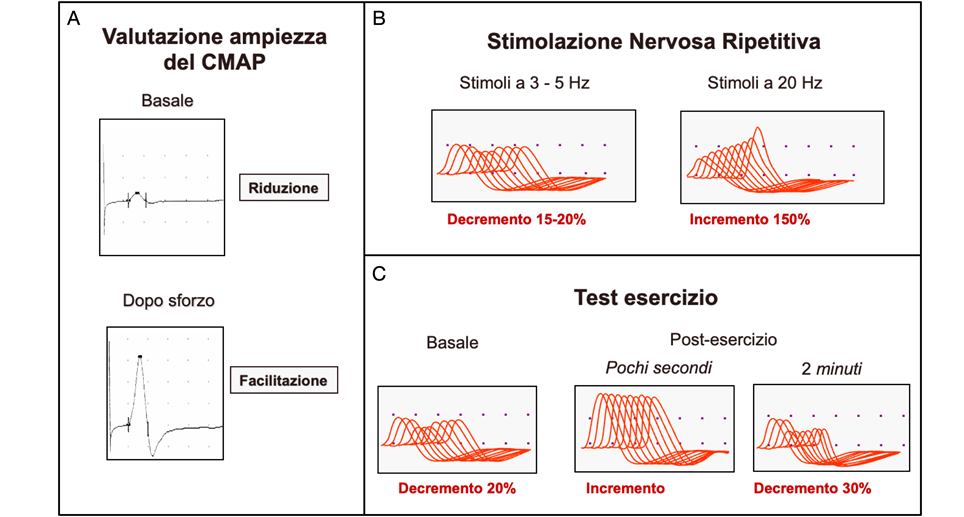
Figura 2. A) Valutazione del CMAP dopo singolo stimolo sopramassimale prima (basale) e dopo breve contrazione muscolare volontaria. B) Nella LEMS la stimolazione ripetitiva a bassa frequenza determina un decremento, mentre la stimolazione ad alta frequenza o una contrazione muscolare massimale di 20 secondi (C), provocano un aumento significativo dell’ampiezza dei CMAP.
